Báo cáo đề xuất cấp giấy phép môi trường nhà máy sản xuẩt thuốc Đông Dược
Báo cáo đề xuất cấp (GPMT) giấy phép môi trường nhà máy sản xuẩt thuốc Đông Dược. Sản phẩm của cơ sở là các loại thuốc đông dược các loại: dạng rắn, dạng dung dịch, dạng viên nang mềm, dạng ống bẻ; thực phẩm chức năng các loại.
Ngày đăng: 24-06-2025
515 lượt xem
DANH MỤC CÁC TỪ VÀ CÁC KÝ HIỆU VIẾT TẮT..... 3
DANH MỤC BẢNG................................................................. 4
Chương I.................................................................................... 6
THÔNG TIN CHUNG VỀ DỰ ÁN ĐẦU TƯ............................................. 6
3. Công suất, công nghệ, sản phẩm sản xuất của cơ sở.......................................... 7
3.1. Công suất hoạt động của cơ sở........................................................ 7
3.2. Quy trình công nghệ sản xuất của cơ sở............................................. 8
4. Nguyên liệu, nhiên liệu, vật liệu, điện năng, hóa chất sử dụng, nguồn cung cấp điện, nước của dự án đầu tư..... 39
4.1. Nhu cầu nguyên liệu, vật tư phục vụ sản xuất của cơ sở..................... 39
4.2. Nhu cầu sử dụng nhiên, vật liệu của dự án........................................... 44
4.3. Nhu cầu sử dụng điện............................................................................. 44
5. Các thông tin khác liên quan đến cơ sở............................................. 46
5.1. Các hạng mục công trình của cơ sở..................................................... 46
5.2. Danh mục máy móc, thiết bị của dự án................................................ 48
SỰ PHÙ HỢP CỦA CƠ SỞ VỚI QUY HOẠCH, KHẢ NĂNG CHỊU TẢI CỦA MÔI TRƯỜNG............ 56
1. Sự phù hợp của cơ sở với với quy hoạch bảo vệ môi trường quốc gia, quy hoạch tỉnh, phân vùng môi trường....56
2. Sự phù hợp của dự án cơ sở với khả năng chịu tải của môi trường................... 56
KẾT QUẢ HOÀN THÀNH CÁC CÔNG TRÌNH, BIỆN PHÁP BẢO VỆ MÔI TRƯỜNG CỦA CƠ SỞ...... 57
1. Công trình, biện pháp thoát nước mưa, thu gom và xử lý nước thải........................ 57
1.1. Thu gom, thoát nước mưa....................................................................... 57
2. Công trình, biện pháp xử lý bụi, khí thải.................................................. 67
3. Công trình, biện pháp lưu giữ, xử lý CTR thông thường................ 69
3.2. Đối với CTR thông thường...................................................................... 69
4. Công trình, biện pháp lưu giữ, xử lý CTNH.............................................. 71
5. Công trình, biện pháp giảm thiểu tiếng ồn, độ rung:........................... 72
6. Phương án phòng ngừa, ứng phó sự cố môi trường trong quá trình vận hành thử nghiệm và khi dự án đi vào vận hành... 73
7. Các nội dung thay đổi so với quyết định phê duyệt kết quả thẩm định báo cáo đề án bảo vệ môi trường chi tiết.. 75
Chương IV................................................................................ 77
NỘI DUNG ĐỀ NGHỊ CẤP GIẤY PHÉP MÔI TRƯỜNG............................. 77
1. Nội dung đề nghị cấp phép đối với nước thải....................................... 77
2. Nội dung đề nghị cấp phép đối với khí thải............................................ 78
3. Nội dung đề nghị cấp phép đối với tiếng ồn, độ rung................................. 79
1. Thông tin chung về tình hình thực hiện công tác bảo vệ môi trường..... 81
4. Kết quả kiểm tra, thanh tra về BVMT đối với cơ sở...................................... 88
KẾ HOẠCH VẬN HÀNH THỬ NGHIỆM VÀ CHƯƠNG TRÌNH QUAN TRẮC MÔI
6.1. Kế hoạch vận hành thử nghiệm công trình xử lý chất thải................................ 89
6.2. Chương trình quan trắc chất thải (liên tục và định kỳ) theo quy định của pháp luật... 89
CAM KẾT CỦA CHỦ CƠ SỞ.......................................................... 90
PHỤ LỤC............................................ 93
Chương I
THÔNG TIN CHUNG VỀ DỰ ÁN ĐẦU TƯ
1. Thông tin chủ đầu tư
Chủ cơ sở: Công ty cổ phần thương mại dược vật tư y tế....
Địa chỉ văn phòng: ........phường Tiền Phong, thành phố Thái Bình, tỉnh Thái Bình.
Người đại diện theo pháp luật của chủ cơ sở: Ông Nguyễn Văn Khải, Chức vụ: Chủ tịch Hội đồng quản trị kiêm tổng giám đốc.
- Điện thoại:.........
Giấy chứng nhận đăng ký kinh doanh số ......... cấp lần đầu ngày 04/3/2005 đăng ký thay đổi lần thứ 19 ngày 29/05/2003.
2.Tên cơ sở:
Nhà máy sản xuất thuốc đông dược
Địa điểm cơ sở: .......phường Tiền Phong, thành phố Thái Bình, tỉnh Thái Bình.
Văn bản thẩm định thiết kế xây dựng: Giấy phép xây dựng số 20/GPCTSC ngày 13/4/2015; số 18/GPXD ngày 20/5/2016; số 64/GPCT ngày 11/10/2016.
Quyết định số 3126/QĐ-UBND ngày 24/12/2014 của UBND tỉnh Thái Bình về việc phê duyệt đề án bảo vệ môi trường chi tiết đối với nhà máy sản xuất thuốc đông được của công ty cổ phần thương mại dược vật tư y tế ....; Báo cáo hoàn thành các công trình bảo vệ môi trường theo đề án bảo vệ môi trường chi tiết tháng 10/2016;Quyết định số 3941/QĐ-UBND ngày 26/12/2016 của UBND tỉnh Thái Bình về việc điều chỉnh một số nội dung trong đề án bảo vệ môi trường chi tiết đối với nhà máy sản xuất thuốc đông dược của công ty cổ phần thương mại dược vật tư y tế ....; Quyết định số 2088/QĐ-UBND ngày 03/8/2017 của UBND tỉnh Thái Bình về việc điều chỉnh một số nội dung trong đề án bảo vệ môi trường chi tiết đối với Nhà máy sản xuất thuốc đông dược của công ty cổ phần thương mại dược vật tư y tế ....; Giấy phép xả nước thải và hệ thống công trình thủy lợi số 05/GP-UBND ngày 29/01/2018 của UBND tỉnh Thái Bình;
Quy mô của cơ sở:
+ Phạm vi: Diện tích đất sử dụng 8.002,2 m2 (Căn cứ theo Giấy chứng nhận quyền sử dụng đất số CC 098366 ngày 08/4/2016 của UBND tỉnh Thái Bình số vào sổ cấp GCN “CT” 02791.
+ Quy mô của cơ sở: Tổng mức đầu tư của cơ sở đến năm 2024 là: 252.609.372.768đ, trong đó tài sản ngắn hạn: 204.415.330.124đ, tài sản dài hạn: 48.194.042.644đ. Căn cứ theo khoản 4 điều 9 Luật Đầu tư công thì dự án có tổng mức đầu tư từ 45 tỷ đồng đến dưới 800 tỷ đồng thuộc dự án nhóm B.
Loại hình sản xuất, kinh doanh, dịch vụ: Sản xuất thuốc đông dược - Loại hình sản xuất kinh doanh dịch vụ khác không thuộc loại hình sản xuất, kinh doanh dịch vụ có nguy cơ gây ô nhiễm môi trường.
Yếu tố nhạy cảm về môi trường theo quy định tại khoản 4, điều 25, nghị định 05/2025/NĐ-CP ngày 06/1/2025: Cơ sở không sử dụng đất lúa, không xả nước thải vào nguồn nước mặt cấp nước cho sinh hoạt theo quy định của pháp luật về tài nguyên nước; không sử dụng đất của rừng đặc dụng. Theo quy định tại cột (3), số thứ tự 7c, phụ lục III, Nghị định 05/2025/NĐ-CP ngày 06/1/2025 do đó theo quy định dự án không có yếu tố nhạy cảm về môi trường.
Phân nhóm dự án đầu tư: Dự án nhóm III.
3.Công suất, công nghệ, sản phẩm sản xuất của cơ sở
3.1.Công suất hoạt động của cơ sở
+ Sản xuất, gia công khoảng 60 tấn thuốc đông dược dạng rắn và dạng dung dịch, thực phẩm chức năng;
+ Sản xuất khoảng 40 tấn một số loại sản phẩm có nguồn gốc đông dược gồm: dạng viên nang mềm 12,52 tấn/năm; dạng ống bẻ 11,21 tấn/năm; dạng cream thuốc và mỹ phẩm 3,65 tấn/năm; dạng dung dịch thuốc dùng ngoài - mỹ phẩm 9,85 tấn/năm; thực phẩm chức năng tác dụng giảm cân 2,77 tấn/năm;
+ Chiết xuất rutin nụ hòe: 50 tấn/năm (Hiện tại công ty không chiết xuất rutin nụ hòe và sẽ không sản xuất loại hình này trong tương lai).
3.2.Quy trình công nghệ sản xuất của cơ sở
3.2.1.Quy trình sản xuất thuốc dược liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng rắn (Viên nang cứng, Viên nén)
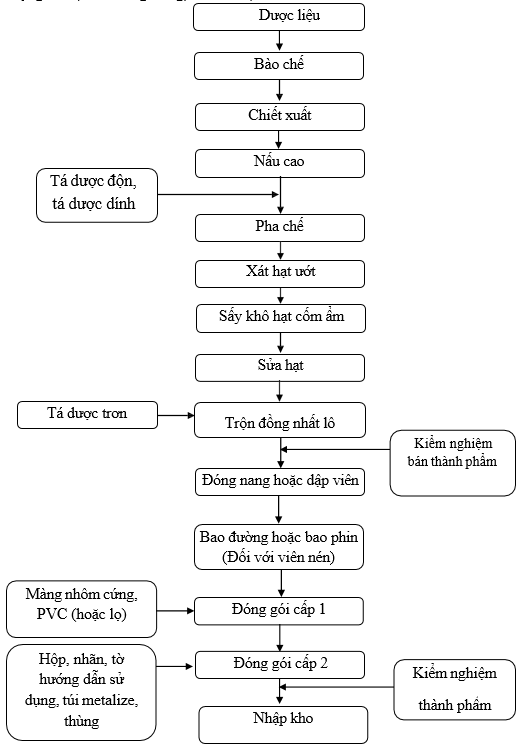
Sơ đồ 1. 1. Sơ đồ quy trình sản xuất thuốc dược liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng rắn (Viên nang cứng, Viên nén)
Thuyết minh quy trình:
Lĩnh dược liệu theo lệnh sản xuất, loại bỏ tạp chất, rửa sạch, bào chế, chế biến theo yêu cầu của từng dược liệu.
Các dược liệu sau khi được bào chế xong đem đi chiết xuất, nấu thành cao để đưa vào pha chế.
Cao dược liệu được pha chế, trộn đều với các tá dược trên máy trộn tạo thành khối bột ẩm đồng nhất.
Khối bột ẩm được chuyển sang máy xát hạt lắc để tạo thành hạt cốm ẩm.
Hạt cốm ẩm được đưa vào tủ sấy để sấy đến khô.
Hạt cốm sau khi khô , được lấy ra để nguội. Chuyển hạt cốm ra sửa hạt trên máy xát hạt lắc.
Hạt cốm khô sau khi đã sửa hạt được trộn với tá dược dính trên máy trộn đồng nhất lô để đồng nhất cả lô sản phẩm. Kiểm tra bán thành cốm phẩm theo tiêu chuẩn.
Cốm đạt yêu cầu được chuyển sang giai đoạn đóng nang hoặc dập viên.
Đối với viên nén, viên đạt yêu cầu chuyển sang giai đoạn bao đường hoặc bao phim.
Chuyển viên vào phòng biệt trữ để chuyển sang giai đoạn đóng gói cấp 1.
Đóng gói cấp 1: Viên được ép vỉ hoặc đóng vào lọ. Trong quá trình ép vỉ, kiểm tra độ kín của vỉ, hình thức của vỉ, vỉ sạch sẽ, không có viên hỏng, trên mỗi vỉ phải có số lô sản xuất, ngày sản xuất và hạn dùng rõ ràng, đúng qui định. Trong quá trình đóng lọ kiểm tra độ kín của lọ đầu lô sản xuất hoặc sau khi có sự cố, cứ 60 phút/lần.
Đóng gói cấp 2: Lĩnh túi metalize (nhãn lọ), hộp carton, thùng carton, tấm đệm carton, băng keo theo đúng lệnh sản xuất. In phun số lô sản xuất, ngày sản xuất, hạn dùng trên nhãn, hộp carton bằng máy in phun.
+ Đối với dạng vỉ: Xếp vỉ cho vào túi metalize. Hàn miệng túi bằng máy hàn miệng túi.
+ Đối với dạng lọ: Dán nhãn chắc chắn, ngay ngắn trên các lọ in số lô sản xuất, ngày sản xuất và hạn dùng rõ ràng, đúng qui định.
+ Đóng hộp: Cho túi metalize hoặc lọ vào một hộp carton, kèm theo 01 tờ hướng dẫn sử dụng. Dán tem đảm bảo lên hộp.
+ Đóng thùng: Xếp hộp và phiếu đóng gói vào thùng theo quy định. Dưới đáy và trên cùng của thùng có lót tấm đệm carton. Dán băng keo.
+ Chuyển thùng đã đóng gói sang khu biệt trữ, dán nhãn biệt trữ chờ kết quả kiểm nghiệm thành phẩm.
Sau khi thành phẩm đóng gói xong, có phiếu kiểm nghiệm đạt tiêu chuẩn và có lệnh xuất xưởng đem nhập kho.
Bảo quản nơi khô mát, tránh ánh sáng, nhiệt độ dưới 30 0C.
3.2.2.Quy trình sản xuất thuốc dược liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng viên hoàn cứng
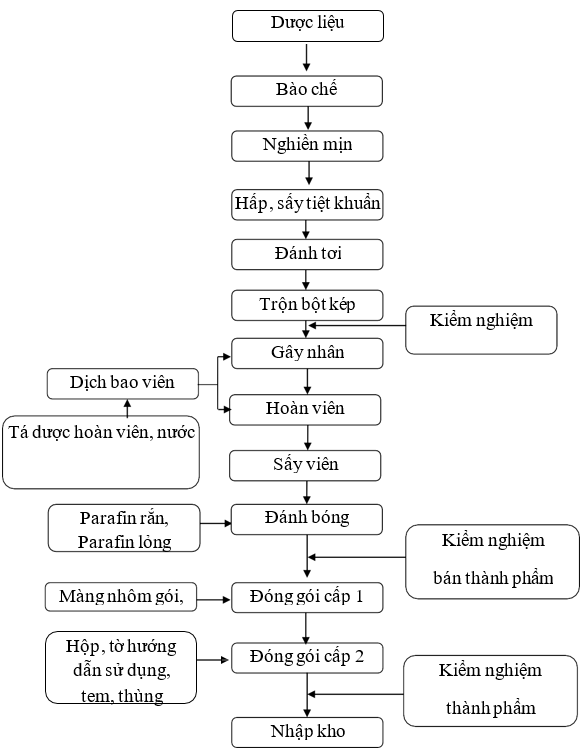
Sơ đồ 1. 2. Sơ đồ quy trình sản xuất thuốc dược liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng viên hoàn cứng
Thuyết minh quy trình:
Lĩnh dược liệu theo lệnh sản xuất, loại bỏ tạp chất, rửa sạch, bào chế, chế biến theo yêu cầu của từng dược liệu sau đó sấy khô.
Các dược liệu sau khi sấy khô đưa đi nghiền mịn trên máy nghiền mịn
Chuyển bột mịn sang phòng hấp, sấy tiệt khuẩn. Bật chế độ hấp của tủ sấy, hấp tiệt khuẩn ở nhiệt độ 1210C trong khoảng 20 phút. Hết thời gian hấp, tắt chế độ hấp, bật chế độ sấy của tủ. Sấy bột ở 600C đến khi hàm ẩm <5,0%. (Kiểm tra nhanh bằng máy cân đo độ ẩm cấp tốc).
Bột dược liệu sau khi hấp, sấy tiệt khuẩn được chuyển sang phòng đánh tơi sau đó chuyển bột dược liệu sang trộn đồng nhất lô. Lấy mẫu kiểm nghiệm bán thành phẩm kiểm tra các chỉ tiêu: Độ ẩm, Định tính, Độ nhiễm khuẩn.
Nấu dịch bao: Lĩnh tá dược bao viên và nước tinh khiết theo công thức. Tiến hành nấu dịch bao trên nồi nấu dịch.
Gây nhân: gây nhân theo công thức, tiến hành gây nhân bằng nồi bao viên như sau: Cho hạt đường trắng vào nồi bao. Rưới ẩm hạt đường bằng dịch bao. Rắc dần bột kép để tạo ra hạt nhân. Cứ tiếp tục rưới ẩm và rắc dần bột kép để tạo thành nhân viên cỡ đường kính khoảng 1 mm. Dùng sàng inox cỡ f = 1 mm để sang phân loại hạt. Hạt trên sàng là hạt đạt yêu cầu, lấy ra để riêng. Hạt dưới sàng tiếp tục bao như trên. Nhân thu được chuyển sang giai đoạn bao viên.
Bao viên: Bao viên được chia thành hai cộng đoạn bao viên mộc và bao màu tiến hành cụ thể như sau:
+ Bao viên mộc: Cho nhân viên vào nồi bao. Rưới dịch bao lên nhân cho đủ ẩm. Rắc vừa đủ bột kép để cho bám một lớp mỏng vào nhân viên tạo thành viên mộc. Tiếp tục bao bồi dần dần như trên cho đến khi tạo thành viên mộc đạt kích thước khoảng 5 mm. Dùng sàng cỡ 5 mm và 6 mm để phân loại viên. Lấy viên trên sàng 5 mm và dưới sàng 6 mm. Viên to trên sàng 6 mm thì loại. Sấy khô, bảo quản, ghi nhãn, để lại ghế vào lô sau. Viên lọt sàng 5 mm thì bao tiếp đến khi đạt yêu cầu.
+ Bao màu: Cho viên mộc vào nồi bao. Để nồi bao quay 15 phút cho viên nhẵn. Rưới dịch bao cho ẩm viên đã bao mộc, rắc dần bột than cho bám đều vào viên. Vận hành nồi bao cho đến khi viên đen đều là đạt. Sấy viên: Viên đã bao áo than cho vào khay sạch mỗi khay khoảng 2,5 - 3 kg. Xếp khay vào tủ sấy tĩnh. Sấy viên trong 30 - 40 phút đầu phải lắc khay (để tránh viên dính chập vào nhau). Sấy ở nhiệt độ 60 - 70 0C Trong thời gian khoảng 12 -15 giờ. Sấy đến khi viên đạt hàm ẩm quy định từ 5 - 6 %. Trong thời gian sấy cứ 2 giờ đảo khay một lần. Đủ thời gian sấy, tắt tủ sấy, để nguội, lấy viên ra khỏi tủ sấy. Sàng phân loại viên một lần nữa. Viên dưới sàng 5 mm, viên trên sàng 6 mm thì loại ghế vào lô sau.
Đánh bóng viên: Nấu chảy Parafin rắn trong xoong inox 5 lít bằng bếp điện (không để Parafin sôi), đổ Parafin rắn vào khuấy đều. Đánh bóng trên nồi bao viên. Cho vào nồi bao viên bán thành phẩm đã sấy đạt yêu cầu. Bật gió nóng sấy nồi bao khoảng 15 phút. Rưới dần Parafin lỏng vào nồi bao. Vận hành nồi bao cho đến khi viên nhẵn bóng là được, khoảng 30 phút. Đựng viên sau đánh bóng trong các túi PE khô, sạch rồi cho vào trong các thùng nhựa có nhãn bán thành phẩm đúng theo quy định. Chuyển viên vào phòng biệt trữ chờ đóng gói.
Đóng gói cấp 1: Viên được đóng túi hoặc đóng vào lọ. Trong quá trình đóng túi, kiểm tra độ kín của túi, hình thức của túi, túi sạch sẽ, không có viên hỏng, trên mỗi túi phải có số lô sản xuất, ngày sản xuất và hạn dùng rõ ràng, đúng qui định. Trong quá trình đóng lọ kiểm tra độ kín của lọ đầu lô sản xuất hoặc sau khi có sự cố, cứ 60 phút/lần.
Đóng gói cấp 2: Lĩnh nhãn lọ, hộp carton, thùng carton, tấm đệm carton, băng keo theo đúng lệnh sản xuất. In phun số lô sản xuất, ngày sản xuất, hạn dùng trên nhãn, hộp carton bằng máy in phun.
+ Đối với dạng lọ: Dán nhãn chắc chắn, ngay ngắn trên các lọ in số lô sản xuất, ngày sản xuất và hạn dùng rõ ràng, đúng qui định.
+ Đóng hộp: Cho túi hoặc lọ vào một hộp carton, kèm theo 01 tờ hướng dẫn sử dụng. Dán tem đảm bảo lên hộp.
+ Đóng thùng: Xếp hộp và phiếu đóng gói vào thùng theo quy định. Dưới đáy và trên cùng của thùng có lót tấm đệm carton. Dán băng keo.
+ Chuyển thùng đã đóng gói sang khu biệt trữ, dán nhãn biệt trữ chờ kết quả kiểm nghiệm thành phẩm.
Sau khi thành phẩm đóng gói xong, có phiếu kiểm nghiệm đạt tiêu chuẩn và có lệnh xuất xưởng đem nhập kho.
Bảo quản nơi khô mát, tránh ánh sáng, nhiệt độ dưới 30 0C.
3.2.3.Quy trình sản xuất thực phẩm bảo vệ sức khoẻ dạng viên nang mềm
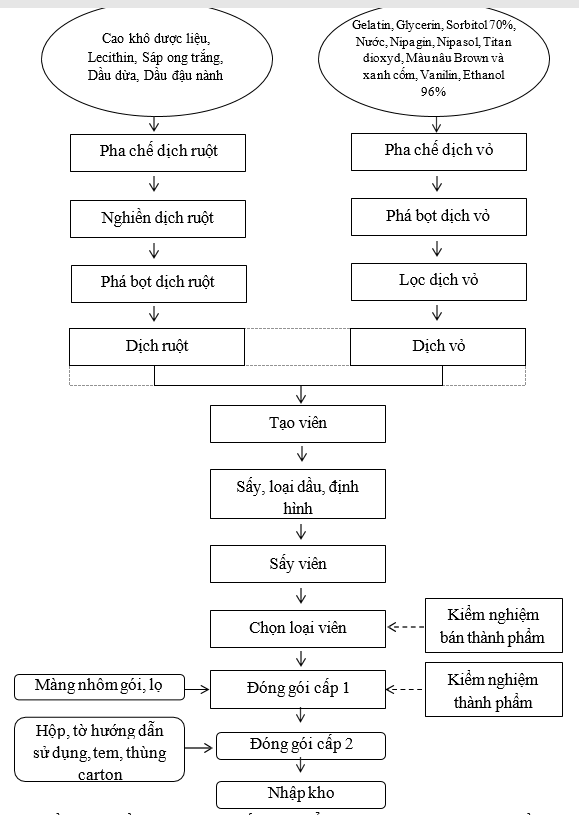
Sơ đồ 1. 3. Sơ đồ quy trình sản xuất thực phẩm bảo vệ sức khoẻ viên nang mềm
Thuyết minh qui trình
Nguyên phụ liệu phải được kiểm nghiệm đạt tiêu chuẩn trên mới được đưa vào sản xuất. Lĩnh theo lệnh sản xuất.
Cân chia nguyên liệu tại phòng cân chia theo công thức lô/ mẻ để đưa vào pha chế dịch ruột và pha chế dịch vỏ.
Pha chế dịch vỏ tại phòng pha chế dịch vỏ: Pha chế dịch vỏ bằng thùng pha chế dịch vỏ. Sau khi pha chế xong dịch vỏ tiến hành phá bọt và lọc dịch vỏ cho vào nồi ủ dịch vỏ. Đẩy nồi ủ dịch vỏ sang phòng tạo viên. Duy trì nhiệt độ thùng chứa ở 35-45ºC, ủ dịch gelatin khoảng 4 giờ.
Pha chế dịch ruột tại phòng pha chế dịch ruột: Pha chế dịch ruột trên thùng pha chế dịch ruột. Sau khi pha chế, dịch ruột được nghiền qua máy nghiền keo, chuyển vào thùng pha chế để phá bọt dịch ruột, cuối cùng chuyển dịch ruột từ thùng pha chế dịch ruột sang nồi ủ dịch ruột để bảo quản chờ tạo nang. Chuyển nồi ủ dịch ruột vào phòng tạo nang.
Tạo nang, sấy sơ bộ định hình viên tại phòng tạo nang: Tiến hành tạo nang trên máy tạo nang mềm, sau khi tạo nang viên được đưa vào lồng sấy khô định hình. Khi viên đã se mặt cho tháo viên, hứng vào khay chuyên dụng chuyển vào phòng sấy viên.
Phòng phơi viên: Các chồng khay được sắp xếp theo thứ tự thời gian ngăn nắp trong phòng sấy, mỗi chồng khay được treo phiếu theo dõi thời gian. Điều kiện sấy: Nhiệt độ 20-220C, độ ẩm 20-23%. Sấy viên trong phòng sấy tới khi viên khô rời, dẻo dai đạt các tiêu chuẩn quy định (độ ẩm của vỏ nang nằm trong khoảng 12-15%, thời gian sấy khoảng 24-28 giờ).
Chọn loại viên: Viên sau khi phơi được chuyển tới phòng chọn loại viên để loại những viên không đạt yêu cầu, những viên đạt yêu cầu được bảo quản trong túi PE chờ đóng gói cấp 1.
Đóng gói cấp 1: Viên được ép vỉ hoặc đóng vào lọ. Trong quá trình ép vỉ, kiểm tra độ kín của vỉ, hình thức của vỉ, vỉ sạch sẽ, không có viên hỏng, trên mỗi vỉ phải có số lô sản xuất, ngày sản xuất và hạn dùng rõ ràng, đúng qui định. Trong quá trình đóng lọ kiểm tra độ kín của lọ đầu lô sản xuất hoặc sau khi có sự cố, cứ 60 phút/lần.
- Đóng gói cấp 2: Lĩnh túi metalize (nhãn lọ), hộp carton, thùng carton, tấm đệm carton, băng keo theo đúng lệnh sản xuất. In phun số lô sản xuất, ngày sản xuất, hạn dùng trên nhãn, hộp carton bằng máy in phun.
+ Đối với dạng vỉ: Xếp vỉ cho vào túi metalize. Hàn miệng túi bằng máy hàn miệng túi.
+ Đối với dạng lọ: Dán nhãn chắc chắn, ngay ngắn trên các lọ in số lô sản xuất, ngày sản xuất và hạn dùng rõ ràng, đúng qui định.
+ Đóng hộp: Cho túi metalize hoặc lọ vào một hộp carton, kèm theo 01 tờ hướng dẫn sử dụng. Dán tem đảm bảo lên hộp.
+ Đóng thùng: Xếp hộp và phiếu đóng gói vào thùng theo quy định. Dưới đáy và trên cùng của thùng có lót tấm đệm carton. Dán băng keo.
+ Chuyển thùng đã đóng gói sang khu biệt trữ, dán nhãn biệt trữ chờ kết quả kiểm nghiệm thành phẩm.
Sau khi thành phẩm đóng gói xong, có phiếu kiểm nghiệm đạt tiêu chuẩn và có lệnh xuất xưởng đem nhập kho.
Bảo quản nơi khô mát, tránh ánh sáng, nhiệt độ dưới 30 0C.
3.2.4.Quy trình sản xuất thuốc dươc liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng lỏng (Siro, cao lỏng)
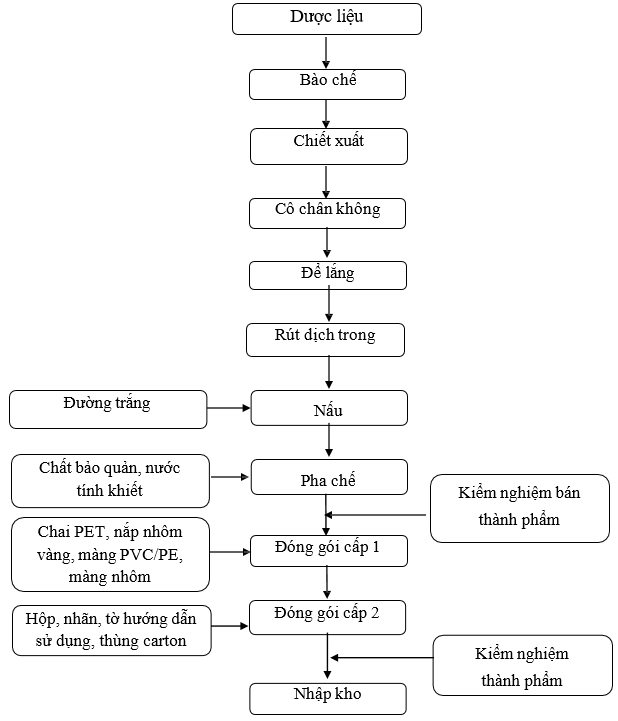
Sơ đồ 1. 4. Sơ đồ quy trình sản xuất thuốc dươc liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng lỏng (Siro, cao lỏng)
Thuyết minh quy trình:
Lĩnh dược liệu theo lệnh sản xuất, loại bỏ tạp chất, rửa sạch, bào chế, chế biến theo yêu cầu của từng dược liệu. Sau đó chuyển dược liệu sang chiết xuất.
Chiết xuất: Dược liệu sau khi bào chế được chiết xuất để lấy dịch chiết trong nồi chiết áp suất hai lần, lần 1 chiết trong 3 giờ, lần 2 chiết trong 2 giờ.
Cô chân không: Dịch chiết được chuyển sang nồi cô chân không, cô đến đạt thể
Để lắng dịch sau khi cô chân không 10- 12 giờ.
Rút dịch trong: Dịch sau khi để lắng được rút dịch trong qua ống siphon, sau đó được bơm lên nồi nấu dịch để nấu.
Nấu: Dịch chiết sau khi để lắng được rút lên nấu, cho tiếp đường trắng vào nồi nấu, bật cánh khuấy, nấu trong 15 phút kể từ khi sôi. Ngừng cấp hơi nước nóng cho nồi nấu, dung dịch sau đó được lọc nóng qua cột lọc có cỡ lỗ lọc 5 µm. Dung dịch thuốc sau khi lọc được chuyển vào thùng pha chế.
Pha chế : Hòa chất bảo quản trong xô inox, khuấy cho tan hoàn toàn, sau đó cho vào thùng pha chế, khuấy đều thành dung dịch đồng nhất. Thêm nước tinh khiết cho vừa đủ thể tích. Kiểm nghiệm bán thành phẩm về chỉ tiêu độ trong, độ đồng nhất, tỷ trọng.
Đóng gói cấp 1: Dung dịch sau pha chế được đóng chai hoặc ép vỉ ống hoặc đóng túi nhôm như sau:
+ Đóng chai: Dung dịch bán thành phẩm đạt tiêu chuẩn đem đóng chai trên máy chiết rót. Cho máy chạy và điều chỉnh lượng dung dịch trong chai đạt thể tích theo quy định. Trong quá trình chiết rót - xiết nắp, thường xuyên kiểm tra hình thức của chai. IPC kiểm tra độ đồng đều thể tích, độ kín của chai ở đầu lô sản xuất hoặc sau khi có sự cố theo SOP (phải có ít nhất 1 lần kiểm tra/ 1 ca). Ghi lại kết quả vào bảng theo dõi. Chai thuốc đạt yêu cầu đựng trong các thùng nhựa, ghi nhãn bán thành phẩm. Chuyển các chai đạt yêu cầu sang đóng gói cấp 2.
+ Ép vỉ ống: Lĩnh PVC/PE theo lệnh sản xuất. Dung dịch thuốc đạt tiêu chuẩn đem đóng ống trên máy đóng ống. Cho máy chạy và điều chỉnh lượng dung dịch trong mỗi ống đạt thể tích theo quy định. Dập in số lô SX, hạn dùng trên mỗi ống. Trong quá trình đóng, thường xuyên kiểm tra hình thức của ống, số lô SX, hạn dùng trên mỗi ống. IPC kiểm tra độ đồng đều thể tích, độ kín của ống ở đầu lô sản xuất hoặc khi thay đổi cuộn màng PVC mới hoặc sau khi có sự cố theo SOP (phải có ít nhất 1 lần kiểm tra/ 1 ca). Ghi lại kết quả vào bảng theo dõi. Ống thuốc đạt yêu cầu đựng trong các thùng nhựa, ghi nhãn bán thành phẩm.
+ Đóng gói nhôm: Lĩnh màng đóng gói theo lệnh sản xuất. Dung dịch thuốc đạt tiêu chuẩn đem đóng gói trên máy đóng gói. Cho máy chạy và điều chỉnh lượng dung dịch trong mỗi gói đạt thể tích theo quy định. Dập in số lô SX, hạn dùng trên mỗi gói. Trong quá trình đóng gói, thường xuyên kiểm tra hình thức của gói, số lô SX, hạn dùng trên mỗi gói. IPC kiểm tra độ đồng đều thể tích, độ kín của gói ở đầu lô sản xuất hoặc khi thay đổi cuộn màng mới hoặc sau khi có sự cố theo SOP (phải có ít nhất 1 lần kiểm tra/ 1 ca). Ghi lại kết quả vào bảng theo dõi. Gói thuốc đạt yêu cầu đựng trong các thùng nhựa, ghi nhãn bán thành phẩm.
Đóng gói cấp 2: Lĩnh nhãn chai, nhãn ống, hộp carton, hướng dẫn sử dụng, cốc chia liều thùng carton, tấm đệm carton, băng keo theo đúng lệnh sản xuất. In phun số lô sản xuất, ngày sản xuất, hạn dùng trên nhãn chai, hộp carton bằng máy in phun.
+ Dán nhãn chai: Dán nhãn chắc chắn, ngay ngắn trên các chai.
+ Dán nhãn ống: Dán nhãn chắc chắn, ngay ngắn lên các ống
+ Đóng hộp: Cho số lượng chai hoặc ống hoặc túi theo quy định kèm tờ hướng dẫn sử dụng vào hộp carton. Đóng nắp hộp, dán tem chống hàng giả lên miệng hộp. IPC kiểm tra nội dung, hình thức, số lô sản xuất, ngày sản xuất, hạn dùng của nhãn chai, hộp, thùng theo SOP để đảm bảo các nội dung đó là đúng và thống nhất trong lô sản xuất.
+ Đóng thùng: Xếp hộp và phiếu đóng gói vào thùng theo quy định. Dưới đáy và trên cùng của thùng có lót tấm đệm carton. Dán băng keo. Chuyển thùng đã đóng gói sang khu biệt trữ, dán nhãn biệt trữ chờ kết quả kiểm nghiệm thành phẩm. Lấy mẫu kiểm nghiệm thành phẩm toàn bộ các chỉ tiêu theo tiêu chuẩn cơ sở.
Nhập kho: Sau khi thành phẩm đóng gói xong, có phiếu kiểm nghiệm đạt tiêu chuẩn và có lệnh xuất xưởng đem nhập kho. Bảo quản nơi khô mát, tránh ánh sáng, nhiệt độ dưới 300C.
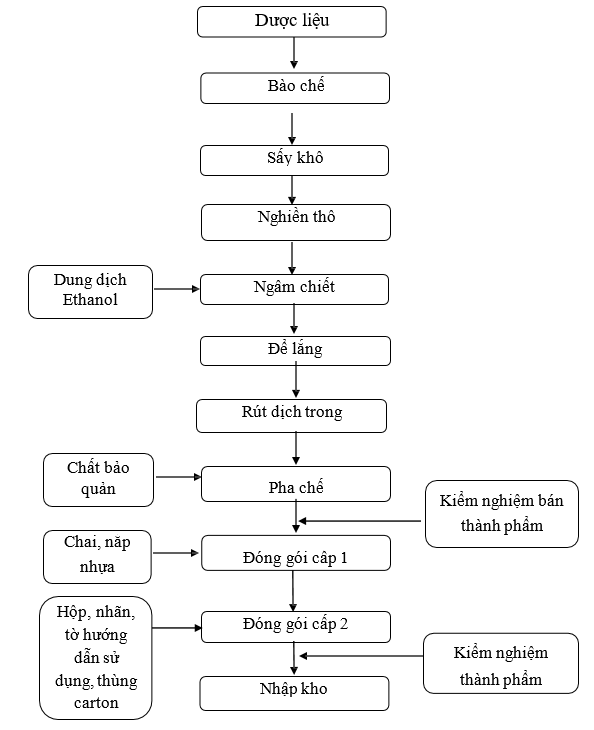
3.2.5.Quy trình sản xuất thuốc dươc liệu, thuốc cổ truyền dạng dung dịch dùng ngoài
Sơ đồ 1. 5. Sơ đồ quy trình sản xuất thuốc dươc liệu, thuốc cổ truyền dạng dung dịch dùng ngoài
Thuyết minh quy trình:
Lĩnh dược liệu theo lệnh sản xuất, loại bỏ tạp chất, rửa sạch, bào chế, chế biến theo yêu cầu của từng dược liệu. Sau đó chuyển dược liệu sang sấy khô.
Sấy khô: Dược liệu được sấy khô trong tủ sấy.
Nghiền thô: Sau khi sấy khô, dược liệu được nghiền thô.
Ngâm chiết: Dược liệu sau khi nghiền thô được cho vào thùng ngâm chiết, sau đó cho thêm dung dịch Ethanol vào ngập bột dược liệu. Tiến hành ngâm chiết bột dược liệu hai lần, lần 1 chiết trong 5-7 ngày, lần 2 chiết trong 3-5 ngày.
Hết thời gian ngâm chiết, tiến hành rút dịch chiết vào thùng chứa. Để lắng dịch khoảng 10- 12 giờ.
Rút dịch trong: Dịch sau khi để lắng được rút dịch trong qua ống siphon, sau đó được bơm vào thùng pha chế.
Pha chế: Hòa chất bảo quản trong xô inox, khuấy cho tan hoàn toàn, sau đó cho vào thùng pha chế, khuấy đều thành dung dịch đồng nhất. Thêm dung dịch Ethanol cho vừa đủ thể tích. Kiểm nghiệm bán thành phẩm về chỉ tiêu độ trong, độ đồng nhất, tỷ trọng.
Đóng gói cấp 1: Dung dịch sau pha chế được đóng chai như sau: Dung dịch bán thành phẩm đạt tiêu chuẩn đem đóng chai trên máy chiết rót. Cho máy chạy và điều chỉnh lượng dung dịch trong chai đạt thể tích theo quy định. Trong quá trình chiết rót - xiết nắp, thường xuyên kiểm tra hình thức của chai. IPC kiểm tra độ đồng đều thể tích, độ kín của chai ở đầu lô sản xuất hoặc sau khi có sự cố theo SOP (phải có ít nhất 1 lần kiểm tra/ 1 ca). Ghi lại kết quả vào bảng theo dõi. Chai thuốc đạt yêu cầu đựng trong các thùng nhựa, ghi nhãn bán thành phẩm. Chuyển các chai đạt yêu cầu sang đóng gói cấp 2.
Đóng gói cấp 2: Lĩnh nhãn chai, hộp carton, hướng dẫn sử dụng, thùng carton, tấm đệm carton, băng keo theo đúng lệnh sản xuất. In phun số lô sản xuất, ngày sản xuất, hạn dùng trên nhãn chai, hộp carton bằng máy in phun. Dán nhãn chắc chắn, ngay ngắn trên các chai. Đóng hộp: Cho chai theo quy định kèm tờ hướng dẫn sử dụng vào hộp carton. Đóng nắp hộp, dán tem chống hàng giả lên miệng hộp. IPC kiểm tra nội dung, hình thức, số lô sản xuất, ngày sản xuất, hạn dùng của nhãn chai, hộp, thùng theo SOP để đảm bảo các nội dung đó là đúng và thống nhất trong lô sản xuất.
+ Đóng thùng: Xếp hộp và phiếu đóng gói vào thùng theo quy định. Dưới đáy và trên cùng của thùng có lót tấm đệm carton. Dán băng keo. Chuyển thùng đã đóng gói sang khu biệt trữ, dán nhãn biệt trữ chờ kết quả kiểm nghiệm thành phẩm. Lấy mẫu kiểm nghiệm thành phẩm toàn bộ các chỉ tiêu theo tiêu chuẩn cơ sở.
- Nhập kho: Sau khi thành phẩm đóng gói xong, có phiếu kiểm nghiệm đạt tiêu chuẩn và có lệnh xuất xưởng đem nhập kho. Bảo quản nơi khô mát, tránh ánh sáng, nhiệt độ dưới 300C.
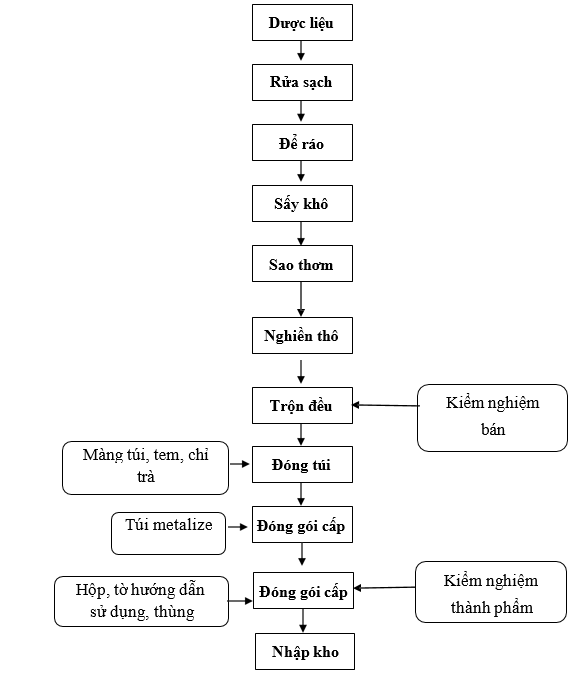
3.2.6. Quy trình sản xuất thuốc dươc liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng trà:
Sơ đồ 1. 6. Sơ đồ quy trình sản xuất thuốc dươc liệu, thuốc cổ truyền, thực phẩm bảo vệ sức khoẻ dạng trà
Thuyết minh quy trình:
Lĩnh dược liệu theo lệnh sản xuất, loại bỏ tạp chất, rửa sạch, để ráo nước, bào chế, chế biến theo yêu cầu của từng dược liệu. Sau đó chuyển dược liệu sang sấy khô.
Sấy khô: Dược liệu được sấy khô trong tủ sấy.
Sao thơm: Dược liệu sau khi sấy được sao thơm.
Nghiền thô: Sau khi sao thơm, dược liệu được nghiền thô.
Trộn đều: Bột dược liệu được trộn đều cho đồng nhất trên máy trộn lập phương. Sau khi trộn, kiểm tra khối lượng bột dược liệu, lấy mẫu kiểm tra chỉ tiêu định tính, của bột dược liệu.
Đóng túi: Lĩnh màng túi trà, chỉ trà, tem trà theo lệnh sản xuất. Bột dược liệu được đóng túi trên máy đóng túi trà. Cho máy chạy và điều chỉnh khối lượng bột trong túi theo quy định. Trong quá trình đóng túi, thường xuyên kiểm tra hình thức của túi. IPC kiểm tra độ đồng đều khối lượng ở đầu lô sản xuất hoặc sau khi có sự cố theo SOP (phải có ít nhất 1 lần kiểm tra/ 1 ca). Ghi lại kết quả vào bảng theo dõi. Chuyển các chai đạt yêu cầu sang đóng gói cấp 1.
Đóng gói cấp 1: Lĩnh túi metalize theo lệnh sản xuất. Túi trà được cho vào túi Metalize sau đó được hàn chặt miệng túi. IPC kiểm tra độ kín của túi ở đầu lô sản xuất hoặc sau khi có sự cố theo SOP (phải có ít nhất 1 lần kiểm tra/ 1 ca). Chuyển túi Metalize sang đóng gói cấp 2.
Đóng gói cấp 2: Lĩnh hộp carton, hướng dẫn sử dụng, thùng carton, tấm đệm carton, băng keo theo đúng lệnh sản xuất. In phun số lô sản xuất, ngày sản xuất, hạn dùng lên hộp carton bằng máy in phun. Đóng hộp: Cho số lượng túi Metalize theo quy định kèm tờ hướng dẫn sử dụng vào hộp carton. Đóng nắp hộp, dán tem chống hàng giả lên miệng hộp. IPC kiểm tra nội dung, hình thức, số lô sản xuất, ngày sản xuất, hạn dùng của nhãn chai, hộp, thùng theo SOP để đảm bảo các nội dung đó là đúng và thống nhất trong lô sản xuất.
+ Đóng thùng: Xếp hộp và phiếu đóng gói vào thùng theo quy định. Dưới đáy và trên cùng của thùng có lót tấm đệm carton. Dán băng keo. Chuyển thùng đã đóng gói sang khu biệt trữ, dán nhãn biệt trữ chờ kết quả kiểm nghiệm thành phẩm. Lấy mẫu kiểm nghiệm thành phẩm toàn bộ các chỉ tiêu theo tiêu chuẩn cơ sở.
Nhập kho: Sau khi thành phẩm đóng gói xong, có phiếu kiểm nghiệm đạt tiêu chuẩn và có lệnh xuất xưởng đem nhập kho. Bảo quản nơi khô mát, tránh ánh sáng, nhiệt độ dưới 300C.
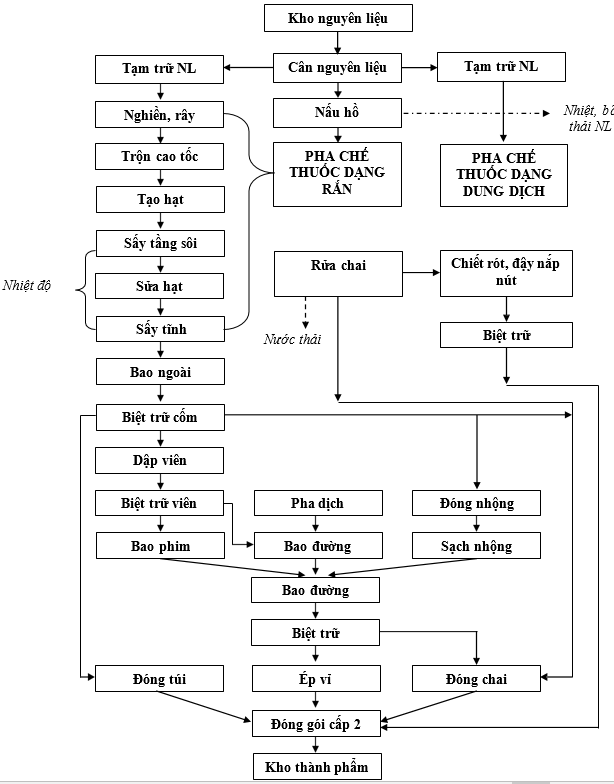
3.2.1.Quy trình sản xuất thuốc đông y dạng rắn và dạng dung dịch:
Sơ đồ 1. 7. Sơ đồ quy trình sản xuất thuốc đông dược của cơ sở
Thuyết minh quy trình:
*Mô tả quy trình công nghệ thuốc dạng rắn:
Nguyên liệu được chiết xuất từ dây chuyền chiết xuất cao dược được kiểm nghiệm sau đó nhập kho nguyên liệu. Sau khi nhận lệnh sản xuất, quản đốc phân xưởng tổ chức thực hiện sản xuất. Nguyên liệu được đưa qua khu vực vệ sinh bao bì, chốt gió và vào phòng cân. Tại đây, nguyên liệu được cân và chia thành lô sau đó được tạm trữ ở phòng tạm trữ nguyên liệu. Các nhân viên được thay quần áo qua hệ thống các phòng thay đồ lần1, lần 2 qua phòng rửa tay tiệt khuẩn sau đó qua chốt gió và vào hành lang cấp độ D (WHO). Nguyên liệu được xay và rây tại phòng xay rây, đưa vào máy nhào trộn, tạo hạt và sát rửa hạt, sấy tĩnh để tạo cốm. Cốm đã được tạo ra bao trơn và tạm giữ ở phòng tạm trữ bán thành phẩm 1. Các công đoạn này phải qua kiểm tra sơ bộ ở phòng IPC. Cốm được đem đi đóng túi, đóng nhộng, đóng lọ. Phần khác đưa đi dập viên sau đó viên tạm trữ ở phòng tạm trữ bán thành phẩm 1. Viên nén sau khi đã được kiểm tra đem đi bao phim hoặc bao đường được tạm trữ ở phòng bán thành phẩm 2. Viên nén bao đường, viên nén bao phim, viên nang sau khi kiểm nghiệm đạt tiêu chuẩn chuyển sang ép vỉ, đóng lọ hoặc đóng túi. Bán thành phẩm sau đóng gói cấp 1 được chuyển qua passbox hoặc băng tải sang phòng đóng gói cấp 2.
*Mô tả quy trình công nghệ thuốc dạng dung dịch:
Sau khi nhận lệnh sản xuất quản đốc phân xưởng tổ chức thực hiện sản xuất. Do dược liệu được bào chế, chiết xuất tại dây chuyền chiết xuất cao dược sau đó dịch chiết được chuyển lên phòng pha chế theo hệ thống đường ống. Nguyên liệu được đưa qua khu vực vệ sinh bao bì, chốt gió vào phòng cân. Tại đây nguyên liệu được cân chia thành lô, sau đó tạm trữ ở phòng tạm trữ nguyên liệu. Các nhân viên được thay quần áo qua hệ thống các phòng thay đồ lần 1, lần 2 qua phòng rửa tay tiệt khuẩn sau đó qua chốt gió và vào hành lang cấp độ D (WHO). Nguyên liệu được pha chế với dịch chiết dược liệu và lọc tại phòng pha chế, sau đó lấy mẫu kiểm nghiệm bán thành phẩm. Sau khi kết quả đạt chuyển qua phòng chiết rót đậy nắp nút. Bán thành phẩm sau khi đóng gói cấp 1 được đưa qua phòng đóng gói cấp 2.
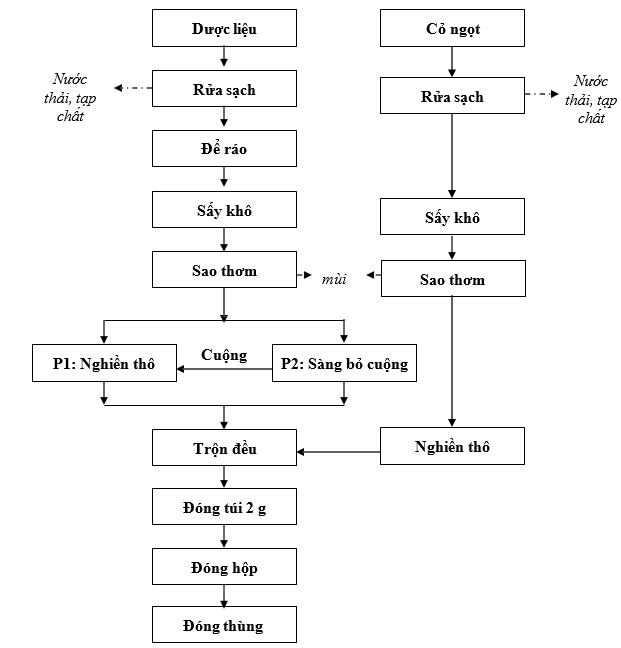
3.2.2.Quy trình sản xuất thực phẩm chức năng:
Quy trình sản xuất thực phẩm chức năng của công ty như sau:
Sơ đồ 1. 8. Quy trình sản xuất thực phẩm chức năng
Thuyết minh quy trình:
* Sơ chế, chế biến dược liệu:
Các dược liệu sau khi lĩnh về được chế biến như sau:
- Nụ vối:
+ Rửa sạch (rửa khoảng 3 lần nước).
+ Để ráo nước từ 6 – 12 giờ.
+ Sấy khô dược liệu ở 50 – 600C đến khi khô (khoảng 2 – 2,5h). Yêu cầu độ ẩm ≤ 3%. Chú ý phải trải đều dược liệu trên các khay, trong quá trình sấy thường xuyên đảo để dược liệu khô đều.
+ Dược liệu sau sấy đem sao cho thơm để tạo mùi và màu cho dược liệu.
+ Chia dược liệu đã sấy khô làm hai phần. Phần 1: 70% nụ vối để nghiền thô.
Phần 2: 30% nụ vối.
- Cỏ ngọt:
+ Nhặt bỏ loại tạp chất.
+ Rửa sạch (rửa khoảng 3 lần nước), để ráo nước.
+ Sấy khô dược liệu ở 60 – 700C đến khi khô giòn (khoảng 8 – 12h). Yêu cầu độ ẩm ≤ 3%. Chú ý phải trải đều dược liệu trên các khay, trong quá trình sấy thường xuyên đảo để dược liệu khô đều. Sao thơm.
+ Dược liệu sau sấy khô chuyển sang nghiền thô.
*Sàng loại cuộng phần 2:
- Sàng cuộng ở phần 2. Cuộng sau khi sàng loại được phối hợp với phần 1 nụ vối. Chuyển sang nghiền thô.
- Phần dược liệu đã loại cuộng được chuyển sang trộn đều với các bột dược liệu.
* Nghiền dược liệu:
Nghiền thô riêng từng vị:
+ Nghiền thô (không lắp sàng) phần 1 nụ vối và cuộng đã sàng loại của phần 2 nụ vối.
+ Nghiền thô cỏ ngọt qua rây 2000.
*Trộn đều.
- Trộn đều các bột dược liệu đã sàng loại cuộng (Phần 2) theo công thức. Đóng bột trong hai lần túi PE buột kín để đảm bảo không bị hút ẩm. Chuyển các túi PE sang phòng đóng túi lọc.
*Đóng túi:
- Cho máy đóng túi lọc chạy và điều chỉnh khối lượng bột trong túi đạt 2g/ túi, sai số cho phép ± 10%. Trong quá trình đóng túi cứ 15 phút người đóng túi kiểm tra khối lượng túi 1 lần.
*Đóng hộp:
- Dựng hộp ngay ngắn, cài đáy hộp.
- Xếp 20 túi 2g/ 1 túi miết/ Hộp. Cài nắp hộp. Dán tem lên miệng hộp.
- Chuyển hộp sang co màng.
*Đóng thùng:
- Dựng thùng carton trà nụ vối, dán băng dính khổ rộng lên đáy thùng đảm bảo chắc chắn. Xếp 100 hộp và 01 phiếu đóng gói vào 1 thùng đã có bìa lót. Dùng băng dính khổ rộng dán chắc chắn miệng thùng.
- Chuyển thùng đạt tiêu chuẩn vào kho.
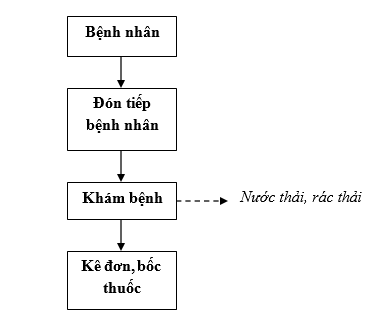
3.2.3.Quy trình khám chữa bệnh:
Quy trình khám chữa bệnh tại quầy thuốc đông y của nhà máy gồm các bước như sau:
Sơ đồ 1. 9. Quy trình khám chữa bệnh
Thuyết minh quy trình:
Đón tiếp bệnh nhân khám bệnh tại quầy thuốc đông y: Bác sỹ khám bệnh sẽ yêu cầu bệnh nhân cung cấp họ tên, tuổi, địa chỉ.
Khám bệnh:
- Hỏi tình trạng sức khoẻ của bệnh nhân.
- Khám lâm sàng: bắt mạch.
- Đưa ra chẩn đoán bệnh.
- Tư vấn cho bệnh nhân;
Kê đơn, bốc thuốc
- Kê đơn thuốc đông y
- Bốc thuốc đông y.
3.3.Sản phẩm của cơ sở
Sản phẩm của cơ sở là các loại thuốc đông dược các loại: dạng rắn, dạng dung dịch, dạng viên nang mềm, dạng ống bẻ; thực phẩm chức năng các loại (Cao ích mẫu, hoạt huyết, phong tê thấp, kim tiền thảo; các loại trà nụ vối, trà thảo dược, trà nhân trần...); thuốc dùng ngoài - hóa mỹ phẩm.
Danh mục sản phẩm xuất bán năm 2024 của cơ sở được tổng hợp tại bảng sau:
Bảng 1. 1. Danh mục sản phẩm đông dược của cơ sở
|
STT |
Tên vật tư |
ĐVT |
Số lượng |
|
1 |
Bổ gan TT |
HỘP |
1.833 |
|
2 |
Bổ tỳ TW chai 60ml |
HOP |
10.054 |
|
3 |
Ceprico |
HOP |
7.000 |
|
4 |
Cốt bình nguyên lọ 60ml |
HOP |
73.912 |
|
5 |
Thanh phế thủy 125ml |
HOP |
57.311 |
|
6 |
Bách Khớp Thảo (5 vỉ x 10 viên) |
HOP |
21.883 |
|
7 |
Bổ tỳ TW ( hộp 20 ống 10 ml) |
HOP |
1.070 |
|
8 |
Bổ gan |
HOP |
41.850 |
|
9 |
Phong thấp PN |
HOP |
23.716 |
|
10 |
Gipat |
HOP |
29.746 |
|
11 |
Gansivi ống 10ml |
HOP |
15.030 |
|
12 |
Diacap |
HOP |
10.297 |
|
13 |
Cao lỏng phong thấp 20 ống x 10ml |
HOP |
2.506 |
|
14 |
Gansivi chai 100ml |
HOP |
7.380 |
|
15 |
Hữu quy |
HOP |
3.047 |
|
16 |
Viên Nghệ mật ong |
HOP |
12.400 |
|
17 |
Hoạt huyết Khải Hà không đường |
HỘP |
2 |
|
18 |
Quy tỳ.VT 90ml |
HOP |
2.879 |
|
19 |
An thần ích trí |
HOP |
129.460 |
|
20 |
Bạch y phong tê thấp |
HOP |
1.000 |
|
21 |
Bạch y phong tê thấp (hộp 15 gói x 5 gam) |
HOP |
20.992 |
|
22 |
Bạch y phong tê thấp (hộp 15 gói x 10gam) |
HOP |
27.295 |
|
23 |
Bảo mạch hạ huyết áp |
HOP |
32.340 |
|
24 |
Bổ thận âm lọ 40g |
HOP |
31.600 |
|
25 |
Cao ích mẫu 125ml |
HOP |
995 |
|
26 |
Cao ích mẫu 100ml |
HOP |
1.620 |
|
27 |
Cao ích mẫu |
CHAI |
400 |
|
28 |
Cao lỏng tiêu độc K/H 100ml |
HOP |
1.318 |
|
29 |
Eyetonic VT (10 vỉ x 10 viên) |
HOP |
15.018 |
|
30 |
Hoạt huyết dưỡng não hộp 5 vỉ |
HOP |
659.237 |
|
31 |
Hoạt huyết dưỡng não lọ 100 viên |
LO |
8.112 |
|
32 |
Hoạt huyết thông mạch 125ml |
HOP |
318.400 |
|
33 |
Hoạt huyết thông mạch ống 15ml (hộp 20 ống) |
ONG |
183.665 |
|
34 |
Hoạt huyết thông mạch 100 ml |
HOP |
76.100 |
|
35 |
Hoạt huyết thông mạch K/H (Hộp 20 gói x 10 ml) |
HOP |
1.965 |
|
36 |
Hoàn sáng mắt K/H |
HOP |
13.827 |
|
37 |
Bổ thận âm (hộp 10 góix4g) |
HOP |
450 |
|
38 |
Hoàn thập toàn đại bổ |
HOP |
19.446 |
|
39 |
Hoàn thập toàn đại bổ lọ 40 g |
HOP |
8.200 |
|
40 |
ích mẫu hộp 2 vỉ |
HOP |
1.360 |
|
41 |
Kahagan hộp 5 vỉ |
HOP |
18.289 |
|
42 |
Kahagan lọ 100 viên |
LO |
14.243 |
|
43 |
Kahagan New |
HOP |
36.389 |
|
44 |
Kim tiền thảo (lọ -100v) |
HOP |
66.221 |
|
45 |
Kim tiền thảo Khải Hà (hộp 6 vỉ x 10 viên) |
HOP |
5.835 |
|
46 |
Kim tiền thảo Khải Hà (hộp 10 vỉ x 10 viên) |
HOP |
84 |
|
47 |
Bạch y phong tê thấp Khải Hà |
LO |
29.730 |
|
48 |
Đại bổ khí huyết (hộp 5 vỉ x 10 viên) |
HOP |
21.100 |
|
49 |
Diệp hạ châu KH (hộp 5 vỉ x 10 viên) |
HOP |
78.800 |
|
50 |
Độc hoạt tang ký sinh (hộp 5 vỉ x 10 viên) |
HOP |
64.763 |
|
51 |
Độc hoạt tang ký sinh (hộp 2 vỉ x 20 viên) |
HOP |
14.700 |
|
52 |
Đại tràng HB (10 vỉ x 10 viên) |
HOP |
7.070 |
|
53 |
Thanh phế thủy |
HOP |
1.310 |
|
54 |
Bát trân (hộp 20 ống x 10ml) |
HOP |
14.900 |
|
55 |
Bổ trung ích khí |
HOP |
48.274 |
>>> XEM THÊM: Thuyết minh dự án đầu tư trồng dược liệu dưới tán rừng và chế biến dược liệu

Tin liên quan
- › Đề xuất cấp giấy phép môi trường dự án đầu tư xây dựng KDC mới
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy thuốc bảo vệ thực vật
- › Đề xuất cấp giấy phép môi trường nhà máy sản xuất đồ điện gia dụng
- › Tham vấn Báo cáo đánh giá tác động môi trường dự án khu nhà ở xã hội
- › Báo cáo GPMT dự án nhà máy chế biến hoa quả xuất khẩu
- › Hồ sơ đề xuất cấp giấy phép môi trường cơ sở sản xuất ván gỗ nhân tạo
- › Báo cáo đề xuất cấp GPMT nhà máy chế biến lương thực
- › Báo cáo đề xuất cấp giấy phép môi trường xưởng phối trộn hóa chất ngành dệt nhuộm
- › DRANCO - Cung cấp các giải pháp xử lý chất thải và sản xuất năng lượng bền vững
- › DRANCO Corporate Presentation 2025
- › Báo cáo đề xuất giấy phép môi trường nhà máy sản xuất thực phẩm
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy sản xuất bột sơn tĩnh điện
















Gửi bình luận của bạn